Besondere Eigenschaften: Brennbarkeit Fixpunkte Wasserlöslichkeit
Tabellen:
Methanol (giftiger Alkohol) Ethanol
(trinkbarer
Alkohol)
Besondere Eigenschaften: Brennbarkeit Fixpunkte
Wasserlöslichkeit
![]()

T F+
Giftig Hochentzündlich
Chemische Formel: CH3OH
alter Name: Methylalkohol!
Vorkommen: Entsteht bei der trockenen Destillation von Holz
(Holzgeist)
Verwendung: Lösungsmittel, Treibstoff
Eigenschaften
Aggregatzustand: flüssig
Farbe: farblos
Geruch: geruchlos
Schmelzpunkt: -97°C
Siedepunkt: 65°C
Dichte: leichter als Wasser
Brennbarkeit: hochentzündlich
Giftigkeit: stark giftig
elektr. Leitfähigkeit: keine
Besonderheiten: bereits der Genuß kleiner Mengen führt zum
Erblinden!
Molekülmasse: 32u
| Struktur: |
H |

T F+
Giftig Hochentzündlich
Chemische Formel:C2H5OH
alter Name: Äthylalkohol
Vorkommen: Entsteht bei Gärung von Früchten
Verwendung: Lösungsmittel, Treibstoff, in Reinigungsmitteln,
zur Desinfektion
Eigenschaften
Aggregatzustand: flüssig
Farbe: farblos
Geruch: geruchlos bis aromatisch
(nach Spiritus)
Schmelzpunkt: -114°C
Siedepunkt: 78°C
Dichte: leichter als Wasser
Brennbarkeit: hochentzündlich
Giftigkeit: giftig, Leber-, Erbschäden,zerstört
Gehirnzellenelektr. Leitfähigkeit:
keine
Besonderheiten: der Genuß kleiner
Mengen erzeugt einen Rausch
Molekülmasse: 46u
| Struktur: |
H H |
Schmelz- und Siedetemperaturen
Sieht man sich die Aggregatzustände der Alkohole unter Normalbedingungen
an, so stellt man fest, dass Alkohole bis zu einer Kettenlänge von 10
Kohlenstoffatomen flüssig sind. Alkanole mit größeren molaren
Massen sind entsprechend fest.
Die Siedetemperatur bei Alkoholen ist wesentlich höher, als bei Alkanen
vergleichbaren
Molmassen .
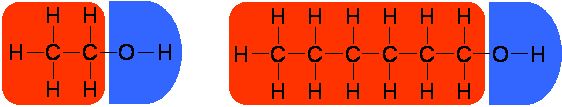
Wasserslöslichkeit
Die Wasserlöslichkeit von Alkanolen hängt
von der Länge der Kohlenwasserstoffkette ab. Die polare Hydroxyl-Gruppe
(OH-Gruppe) sorgt für gute Wasserlöslichkeit, da die Hydroxyl-Gruppe Wechselwirkungen
mit den Wasser-Dipolen eingehen kann. Nimmt die Länge der Kohlenwasserstoffkette zu, so nimmt der Einfluss der
Hydroxyl-Gruppe ab und Löslichkeit
in Wasser wird schlechter.
Brennbarkeit
Kurzkettige Alkohole lassen sich sehr leicht
entzünden und sind brennbar. Beispiele für solche Alkohole sind
Methanol und Ethanol, welche in einem Gemisch mit Wasser ab einer Alkoholkonzentration
von 50 vol.- % zu entzünden sind. Beim Verbrennen reagieren die Alkohole
zusammen mit dem Luftsauerstoff, dabei entsteht Kohlenstoffdioxid (CO2) und
Wasser (H2O).
C2H5OH + 3 O2
---> 2 CO2 + 3 H2O