Die Korrosion
Versuch
Korrosion eines Eisennagels
Man umwickelt einen Eisennagel mit Kupferdraht. In einer Petrischale gibt man eine mit etwas Gelatine eingedickte 0,5-molare Kochsalzlösung zu, die etwas Phenolphthalein und rotes Blutlaugensalz enthält. Anschließend gibt man den Eisennagel in die Lösung.
Beobachtung:
In der Nähe des Nagels entwickelt sich eine Blaufärbung,
während sich weiter außen eine Rotfärbung zeigt. Durch die Blaufärbung läßt sich das Auftreten von
Fe2+-Ionen (Berlinerblau-Reaktion) nachweisen. Außen zeigt die Rotfärbung des Phenolphthaleins OH--Ionen an. Zugleich erkennt man die Bildung von rotbraunem Fe(OH)3.
Man unterscheidet zwischen chemischer Korrosion und
elektrochemischer Korrosion:
A)Chemische Korrosion
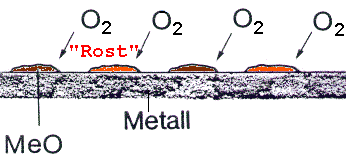
Die chemische Korrosion tritt ein, wenn Sauerstoff in trockener Luft mit Werkstoffen reagiert. Dabei bilden sich die verschiedenen Metalloxide (z. B. schwarzes FeO).
Nur wenn Metalle durch trockene, gasförmige Halogene, Schwefelwasserstoff, Schwefeldioxid oder Sauerstoff angegriffen werden, spricht man von einer chemischen Korrosion. Sobald Luftfeuchtigkeit(Wasser) hinzutritt handelt es sich um elektrochemische Korrosion!

Abb.1: Chemische Korrosion
B)Elektrochemische Korrosion
Tritt Luftfeuchtigkeit zu einem Werkstoff aus Eisen, dessen Schutzschicht beschädigt ist, findet elektro-chemische Korrosion statt. Dabei gehen Fe
2+-Ionenin Lösung und bilden eine Lokalanode. Elektronen
wandern im Lösungsmittel
(H2O bildet OH- Ionen) umherund reagieren mit dem metallischen Eisen, das zur
Lokalkathode wird.
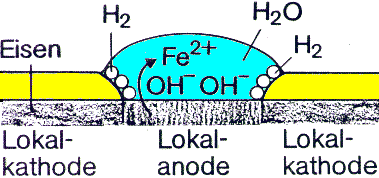
Abb.2: Elektrochemische Korrosion
Vorgänge an der Lokalkathode:
2H
2O + 2e- ---> H2 + 2OH-O
2 + 2H2O + 4e- ---> 4OH-Daher bildet sich an der Lokalkathode auch Wasserstoff.
Die Kationen (Fe2
+) bilden mit den Anionen (OH-) schwerlösliches Eisenhydroxid Fe(OH)2, das durch Luftsauerstoff weiter zu FeO(OH) oxidiert.FeO(OH) und Fe(OH)
2, weiche Substanzen, bildenschließlich sprödes Eisen(III)-oxid Fe
203.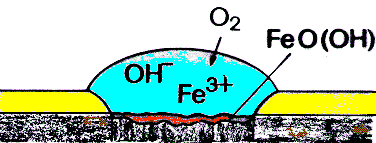
Abb.3: Oxidation der Eisen(II)-Ionen ("Rosten")
C
)Schutz vor elektrochemischer Oxidation1. Schutzanstrich:
Eisen kann man durch einen Überzug aus einem unedleren Metall schützen. Zink eignet sich hierfür besonders.
Zink, das unedlere Metall, fungiert als Lokalanode und geht in Lösung:
Zn ---> Zn
2+ + 2e-Eisen wird wieder zur Lokalkathode:
2H
2O + 2e- ---> H2 + 2OH-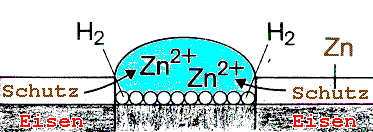
Abb.4: Schutzanstrich aus Zink wird oxidiert
Hier fällt gallertartiges Zinkhydroxid Zn(OH)
2 aus, das durch Wasserabspaltung in hartes, weißes Zinkoxid ZnO übergeht, welches eine neue Schutzschicht bildet.
2. Opferanode
Öltanks oder Pipelines können durch eine Opferanode geschützt werden. Das unedlere Metall (z.B. Magnesium) wird zur Anode und das eiserne Gefäß zur Kathode. Dies schützt vor elektrochemischer Korrosion.