
Die Elektrolyse

Abb.1: Elektrolyse einer Zinkbromidlösung
Was ist eigentlich ?
Ion - Anion - Kation - Kathode - Anode - Ionenbindung -
Atombindung (kovalente Bindung) - Dissoziation - Elektrolyt - Elektroden
Ionen: elektrisch geladene Teilchen
Anionen: negative geladen, werden von der Anode angezogen z.B. Cl
-Kationen:
positiv geladen, werden von der Kathode angezogen z.B. Na+Kathode:
Minus-Pol (negativ)Anode: Plus-Pol (positiv)
Ionenbindung: elektrostatische Anziehungkräfte zwischen Atomrümpfen, die durch Übertragung von Elektronen zustande kommen. z.B. bei Salzen....
Atombindung: (kovalente Bindung) Bindung, bei der sich die Elektronenwolken zweier benachbarter Atome durchdringen und eine gemeinsame Wolke bilden.
Diese Stoffe bilden keine Ionen !
Dissoziation: Spaltung von Molekülen in Ionen (z.B. Wasser 2H2O ---> H3O+ + OH-)
Elektrolyt: elektrisch leitfähige Lösung oder Flüssigkeit, die Ionen enthält oder eine solche Schmelze
Elektroden: Kathode und Anode; aus gleichen oder verschiedene Metallen oder Graphit
Technisch wichtige Elektrolysen
A)Chlor-Alkali-Elektrolyse zur Herstellung von Chlorgas und Natronlauge, Kalilauge usw.
B)Schmelzflußelektrolyse von Kochsalzdient der Herstellung von metallischem Natrium und Chlor
C)Elektrolytische Kupferraffination wird benutzt um das Kupfer, das bei der Verhüttung nur mit einem Reinheitsgrad von 94-98% anfällt zu verfeinern und von Fremdmetallen zu befreien.
D)Schmelzflußelektrolyse von Aluminiumoxid
Die großtechnische Alumniumgewinnung kann nur auf elektrochemischem Wege durch Schmelzflußelektrolyse erreicht werden. Als Ausgangsstoff dient Bauxit, das durch chemischen Aufschluß mit Natronlauge in Tonerde (Al
2O3 = Aluminiumoxid) umgewandelt wird. Um den Schmelzpunkt möglichst niedrig zu halten, setzt man dem Aluminiumoxid Kyrolith (Na3AlF6) hinzu. Damit kann die Elektrolyse bei 950°C durchgeführt werden.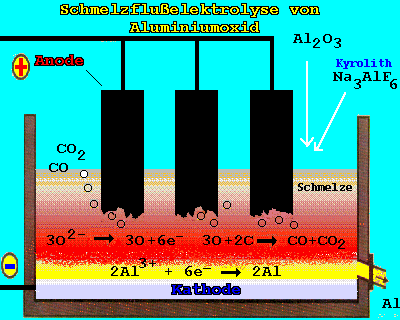
Abb.2: Schmelzflußelektrolyse von Aluminium.