 |
|
| Ätzend |
Ätzend
|
Vorkommen: natürliche Bestandteile von Pflanzen, aber auch in Tieren und Menschen zu finden. Sie können aus Mineralien freigesetzt werden.Verwendung: vielfältige Anwendungen, z.B: als Konservierungsmittel, Würze usw.
Eigenschaften
Aggregatzustand: flüssig, (auch feste Säuren)
Farbe: meist farblos
Geruch: manchmal stechend
Dichte: gering
Brennbarkeit: einige Säuredämpfe sind brennbar
Giftigkeit: ätzend! (manche säuerlicher Geschmack)
elektr. Leitfähigkeit: mit Wasser leitfähig
Besonderheiten: konzentrierte Säuren sind reaktionsfreudig, greifen viele Metalle an,
einige sind sehr giftig!
Gemeinsame Eigenschaften
von Säuren
Säuren kommen in unserem Alltag häufig vor. Einige haben einen sauren Geschmack(Weinsäure, Zitronensäure, Essigsäure), jedoch nicht alle Säuren sind genießbar! Viele Säuren wirken ätzend bzw. sind giftig. Sie können schwere Verletzungen von Haut und Augen hervorrufen. Wegen diesen gefährlichen Eigenschaften darf die Geschmacksprobe nur in Ausnahmefällen gemacht werden.
Säuren sind
verschieden "stark"
Zitronensäure und verdünnte Salzsäure erzielen mit Universal-indikator verschiedene Farbtönungen. Die unterschiedliche Farbtönung eines Universalindikators ermöglicht eine Aussage über die Stärke einer Säure. Der Farbskala ist eine Zahlenskala zugeordnet, der pH-Wert. Mit pH-Papier kann man die Stärke der Säure genauer bestimmen (pH-Wert 0-6). Je stärker die Säure, desto kleiner der pH-Wert bzw. desto kräftiger die Rotfärbung. Laugen zeigen stattdessen ein alkalische Reaktion(8-14) was einer bläulichen Färbung entspricht. Wasser ist neutral (pH-Wert 7); gelbgrüne Färbung.
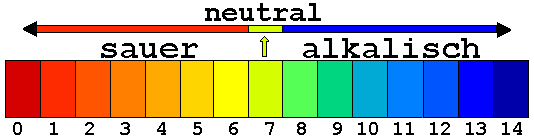
Abb. 1: der pH-Wert
Natürliche Säureanzeiger - Nachweis der Säuren
Es
gibt Stoffe, die Säuren anzeigen: der braune Farbstoff des Tees verändert
sich nach gelb, wenn man Zitronensaft zugibt. Eine ähnliche Farbänderung
erfolgt, wenn man gekochtem Rotkohl Essig zusetzt. Auch die Chemiker kennen
Pflanzenfarbstoffe, die als gefahrlose Erkennungsmittel, “Indikatoren”,
für Säuren verwendet werden können, z.B. Lackmus. Ein Gemisch
verschiedener solcher Indikatoren heißt Universalindikator. Der Universalindikator
kann als Lösung oder als Universalindikatorpapier (sog. pH-Papier)
vorliegen. Das Universalindikatorpapier ist mit einer Mischung verschiedener
Indikatoren getränkt. Wird das Indikatorpapier mit etwas Säure
angefeuchtet, so ändert sich seine Farbe. Die am häufigsten verwendeten
Indikatoren für Säuren sind: Universalindikator, Lackmus, Bromthymolblau
oder pH-Papier. Säuren färben diese Indikatoren rötlich.
Abb.2: handelsübliches pH-Papiers