600 500 400 300 v. Chr.
Die Geschichte der Atommodelle
![]()
600
500
400
300 v. Chr.
In Griechenland gibt es zwei unterschiedliche Auffassungen vom Wesen der Materie....
Die Vierelementenlehre:
Vertreter: Thales, Heraklit, Empedokles, Anaximenes, später auch Platon(427-347 v. Chr.)
und sein Schüler Aristoteles (384-322) »prima materia«
Laut Empedokles besteht die Materie aus den vier Elementen: Feuer, Luft, Wasser und
Erde. Unter dem Einfluß von Liebe und Haß verändern sie sich.
Aristoteles ordnet ihnen Eigenschaften zu, wie trocken (Feuer, Erde), warm (Feuer, Luft),
feucht (Luft, Wasser) und kalt (Wasser, Erde) außerdem "erfindet" er die quinta
essentia: den Äther - ein Fluidum, das in die Materie ein und auszieht und ihre
Eigenschaften und Gestalt ändert.
siehe Abb: Die Vierelementenlehre
Die atomistische Lehre:
Vertreter: Demokrit(Atheist) und Leukipp
Nach Demokrit ist das Atom (atomos = unteilbar) kleinstes Teilchen der Natur
(eines chemischen Elementes), und nicht mehr weiter teilbar. Es gibt eine begrenzte
Anzahl von Atomen, die sich ständig im Raum bewegen.
siehe Abb: Die Atomisten
![]()
0
600
1200 n. Chr.
Aristoteles hat sich mit seiner Lehre durchgesetzt. Erst Ibn Ruschd(1126-1198)
schränkt ein: Die Materie ist begrenzt physikalisch teilbar.
![]()
1200
1500
1750
»Zeit der Alchimie«
Die Alchemie gewinnt Oberhand. R. Bacon (1214 - 1294) und Albertus Magnus (1193 - 1280)
sind typische Vertreter dieser Zeit. Die Elemente werden in Beziehung zu den Sternen
gesetzt - Kupfer (Venus), Silber + Wasser (=Mond),
Gold (Sonne), Eisen (Mars), Zinn (Jupiter), Blei (Saturn), Quecksilber (Merkur). Ein
ganzheitliches Weltbild, das Astrologie und "Esoterik" enthält, aber
atomistische Vorstellungen vernachlässigt, wird entwickelt. Auch Physikern wie Kepler
und später Newton ist die Alchimie nicht fremd. siehe Abb:
Die Sphären der Alchemie
![]()
1750
1800
1850
Daltonsche Atomhypothese
Die Analyse steht wieder im Vordergrund, Synthesen beweisen eigentlich nur noch Analysen. Lavoisier entdeckt eine Reihe von Elementen(Nichtmetalle) und stellt die Oxidationstheorie auf. Dagegen steht noch einige Zeit die Theorie vom Phlogiston, die auf der quinta essentia - dem Äther - des Aristoteles ruht.
Dalton verhilft der "schlafenden" Atomtheorie zum Durchbruch, weil damit quantitative Analysen funktionieren.
- Jedes Element ist aus winzig kleinen, unsichtbaren und unteilbaren
Teilchen, den Atomen, aufgebaut.
- Alle Atome eines Elements sind unter sich gleich, die Atome verschiedener
Elemente aber verschieden, so dass es ebenso viele Atomarten wie Elemente
gibt.
Weil Daltons Atomhypothese sich in der Praxis bewährte wurde sie schließlich
von vielen Wissenschaftlern akzeptiert.
![]()
ab
1850
1900
1950
2000
1869 Periodensystem der Elemente
Obwohl vom Atombau noch nichts bekannt war, ordneten Meyer und Mendelejew im Jahre 1869 alle damals bekannten Elemente nach steigender Atommasse an. Um der periodischen Wiederkehr der Elementeigenschaften gerecht zu werden, ließen sie Plätze für noch unbekannte Elemente frei. Der Zusammenhang zwischen den Atommassen der Elemente und deren Eigenschaften führte zu Perioden und Gruppen, in denen die Elemente mit ähnlichen Eigenschaften untereinander stehen.
Gruppe : Elementfamilie
I : Alkalimetalle
II : Erdalkalimetalle
III : Erdmetalle
IV : Kohlenstoff-Siliziumgruppe
V :
Stickstoff-Phosphorgruppe
VI : Chalkogene
VII : Halogene
VIII/0 : Edelgase
Die erfolgreiche Entdeckung von Elementen und die genaue Übereinstimmung der vorhergesagten Eigenschaften mit den wirklichen Eigenschaften ließ die Phantasie über den Bau der Atom aufblühen. Das Rosinenkuchen-, Erdbeer- und Zwiebelschalenmodell der Gebrüder Thomson folgten rasch aufeinander, bis Ernest Rutherford in seinem berühmten Versuch mit der Goldfolie zeigen konnte, dass Atome fast nur aus leerem Raum bestehen und im Zentrum des Atoms, sich ein positiv geladener Kern befinden muss.
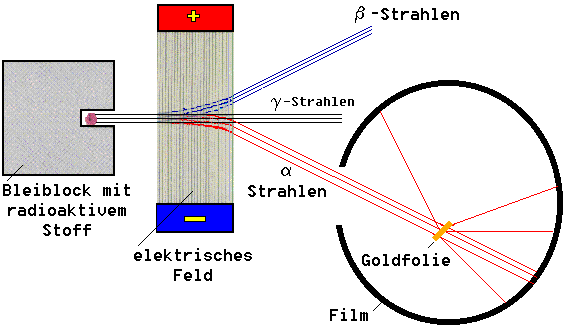
Seitdem stellt sich der Aufbau der Atome wie folgt dar:
|
__________________________________________________________________________________________________________________________________
Zeichenerklärung: + = positiv
- =
negativ n = neutral
Seit 1910 führten eine ganze Reihe von Entdeckungen zu immer präziseren Vorstellungen des Mikrokosmos und verbesserten Atommodellen.
Atommodell nach Bohr
Die Elektronen bewegen sich auf festen Bahnen um den Atomkern
(max. 7 Schalen), ähnlich den Planetenbahnen um die Sonne.
Das Orbitalmodell
ist das aktuellste Atommodell, weil es die dualistische Natur der Elektronen
berücksichtigt. Danach befindet sich jedes Elektron in seinem eigenen
Aufenthaltsraum - dem Orbital, aus dem es bei Energiezufuhr herausspringen kann.
Weitere Erkenntnisse
über den Bau der Atome wurden in der ersten Hälfte des 20. Jahrhunderts gesammelt. Die
Atome radioaktiver Elemente zerfallen spontan. Außerdem können
sie durch Beschuss (mit Neutronen) gespalten werden. Dabei findet eine Kernspaltung statt,
diese Erkenntnis wurde zum Bau der Atombombe und zur Gewinnung von Strom aus Kernenergie
genutzt. Bei der Spaltung verwandelt es sich in andere Atome bzw. radioaktive
Bruchstücke. Die innere Struktur des Atomkerns bilden die Quarks. Inzwischen wurden bis
zu 300 subatomare Teilchen entdeckt.......das Atom besteht aus noch mehr leerem Raum, als
bisher angenommen wurde.