Ionenbindung
Stoffe, die durch Ionen(=elektrisch geladene Teilchen) zusammengehalten werden, erkennt man leicht an ihren typischen Eigenschaften:
- bilden Kristalle
- spröde
- i.d.R. in Wasser löslich
- Schmelzen und Lösungen leiten den el. Strom
- relativ hohe Schmelzpunkte(~500-1500oC)
Aus Ionenverbindungen bestehen alle Salze
sowie Metalloxide und die viele gesteinsbildende Minerale.
Wie entstehen Ionenverbindungen
?
Kochsalz ist ein typisches Beispiel für
einen Vertreter einer Ionenbindung. Es bildet klare, z.T. sehr große
Kristalle, die sich mit dem Hammer spalten lassen. Legt man Kochsalzkörner
auf eine heiße Herdplatte, dann knistert es - ein Beweis dafür,
daß die Kristalle längs der Kristallgitterachsen brechen. Sowohl
eine Kochsalzschmelze als auch das in Wasser gelöste Salz leitet den
elektrischen Strom. Reines Kochsalz zum Schmelzen zu bringen erfordert
wegen des hohen Siedepunktes viel Energie.
Kochsalz = Natriumchlorid
Die Elemente, aus denen Kochsalz besteht,
zeigen in starkem Maße das Bestreben Elektronen abzugeben(Natrium)
bzw. aufzunehmen (Chlor), um eine vollbesetzte Außenschale (Edelgaskonfiguration)
zu erreichen. Natrium besitzt auf seiner Außenschale ein freies Elektron.
Gibt es dieses ab, bleibt ein positiv geladener Atomrumpf - ein Natriumion
- zurück. Das Chlor, das mit seinen sieben Außenelektronen,
begierig auf der Suche nach freien Elektronen ist, um eine vollbesetzte
Achterschale zu erreichen - zieht das freie Elektron in seine Außenschale
hinein und wird dadurch negativ aufgeladen. Die beiden nun elektrisch geladenen
Teilchen - das Natrium-Ion(Na+) und das Chlorid-Ion(Cl-)
- ziehen sich durch ihre unterschiedlichen Ladungen gegenseitig an und
bilden so eine Grundeinheit für die kubische Gitterstruktur des Kochsalzes(Abb.1).
Diese Struktur ist leicht zu erkennen, denn Kochsalz bildet typisch ausgebildete
würfelförmige Kristalle, die auch sehr schön unter dem Mikroskop
oder einer Videokamera mit Zoomobjektiv(20x) zu sehen sind.
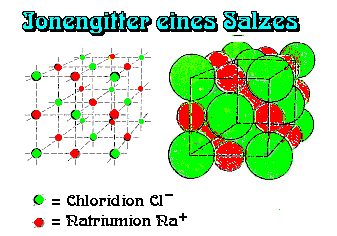
Abb.1: Gittermodell von Kochsalz (Natriumchlorid)