|
|
|
 F Leicht entzündlich |
|
|
|
 F Leicht entzündlich |
Lithium
ist das leichteste der Alkalimetalle. Es schwimmt sogar auf
Benzin und Alkohol. Lithium besitzt ein Valenzelektron auf seiner Außenschale,
das leicht chemische Bindungen eingeht.
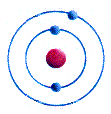 Atombau:
3p 3n 3e-
Atombau:
3p 3n 3e-
Natrium
ist ein typischer Vertreter der Alkalimetalle. Es ist ätzend,
weich, leicht schneidbar , zeigt einen silbrigen Glanz an der frischen Schnittstelle,
der rasch matt anläuft. Es ist an Luft unbeständig und muß daher
unter Petrolium aufbewahrt werden. Natrium zersetzt sich in Wasser rasch unter
Bildung einer Lauge.
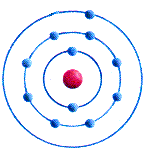 Atombau:
11p 12n 11e-
Atombau:
11p 12n 11e-
Kalium, Rubidium, Cäsium
Alle Alkalimetalle bilden an der Luft aufgrund ihrer Unbeständigkeit
rasch Oxide, mit Wasser Laugen und nach dem Eindampfen feste, weiße, ätzende
und wasseranziehende Hydroxide. Die Reaktionen mit den Halogenen der 7. Hauptgruppe
sind sehr heftig, zum Teil explosiv (z.B. Cs + F --->
CsF )
Alkalimetalle und ihre Verbindungen zeigen typische Flammenfärbungen:
Lithium - karminrot
Natrium - gelborange
Kalium - violett "fliederfarben" (Kobaltglas verwenden!)
Rubidium - rotviolett (im Spektroskop: rubinrot)
Cäsium - blauviolett (im Spektroskop: blau)